Химиотерапия – один из центральных методов лечения раковых заболеваний. Пациентам назначается введение цитостатических средств, которые вмешиваются в цикл пролиферации раковых клеток. Активные ингредиенты вводят в форме инфузий, шприцев или таблеток. Некоторые препараты от раковых заболеваний более эффективны и безопасны, чем другие. Знание механизма действия лекарств и их безопасности поможет выбрать эффективный медикамент.
Роль лекарственных препаратов в лечении онкологии
Химиотерапия обычно относится к лечению злокачественных опухолей химическими веществами, которые препятствуют циклу деления раковых клеток. Они называются «химиотерапевтическими», или «цитостатическими» средствами.
Лекарственные средства в первую очередь направлены против генетического материала клеток, которые находятся в фазе размножения. Даже здоровые клетки делятся и размножаются, поэтому они могут быть атакованы «цитостатиками». Однако их эффект особенно интенсивен в быстрорастущих тканях. Поскольку скорость деления клеток многих видов рака очень высока, они, как правило, чаще более восприимчивы к действию цитотоксических лекарств.
В отличие от хирургии и облучения, химиотерапия с применением лекарств действует на всё тело. Лекарственные средства, вводимые в виде таблеток, шприцев или инфузий, распределяются в различных органах и разрушают потенциально рассеянные опухолевые клетки. Исключением является мозг, в который из-за так называемого «гематоэнцефалического барьера» могут проникать только определенные цитостатики.
Системная химиотерапия позволяет лечить пациента на поздних стадиях рака, при котором уже есть дочерние опухоли. Однако даже на ранних стадиях рака химиотерапия используется для поддержки других процедур: многие опухоли рано образуют крошечные вторичные опухоли, так называемые микрометастазы, которые еще не видны доступными методами визуализации.
Микрометастазы можно «выследить» с помощью химиотерапии и уничтожить. Также возможна местная химиотерапия, при которой цитостатические агенты оказывают свое воздействие непосредственно на опухолевую ткань.
Примером является так называемая «трансартериальная химиоэмболизация». В этом случае активные ингредиенты проходят через печеночную артерию в печень и атакуют рак печени или метастазы.
Виды средств
Цитостатические лекарства ингибируют деление и неконтролируемый рост опухолевых клеток. Некоторые вещества создают ошибки в ДНК опухолевых клеток или препятствуют копированию генома, что важно для деления клетки. Другие препараты от рака влияют на метаболизм клетки.
Поврежденные или мертвые клетки распознаются и разлагаются эндогенным механизмом контроля. Если терапия начнется, опухоль станет меньше или, по крайней мере, не будет расти дальше. Успех химиотерапии, однако, не возникает в одночасье: обычно требуется несколько дней или даже недель, чтобы увидеть эффект.
Успех лечения контролируется с регулярными интервалами. Лечение считается успешным, если опухоль больше не растет, уменьшилась или полностью исчезла. Аналогичным образом, улучшение субъективного благополучия пациента считается положительным эффектом.
В противораковой терапии существует более 50 различных препаратов против клеточного деления (цитостатики). Различные классы лекарств атакуют раковые клетки на разных фазах клеточного цикла. Поэтому при лечении часто несколько веществ объединяют вместе, чтобы получить как можно больший эффект.
Алкилирующие средства
В определенных концентрациях алкилирующие средства обладают цитотоксическим действием. Если определенная степень алкилирования ДНК превышена, клеточный цикл останавливается.
Алкилирующие препараты могут также разрушать ковалентные связи в цепях ДНК в более высоких концентрациях. Разрывы и перекрестные связи представляют собой гораздо более серьезное повреждение ДНК. Оба предотвращают правильную репликацию пораженной ДНК во время деления клеток при значительно более низких концентрациях и приводят к остановке клеточного цикла.
В более высоких концентрациях они приводят к разрывам нитей ДНК. Бифункциональные алкилирующие агенты также могут химически постоянно связывать две цепи ДНК. Все лекарства этой группы обладают потенциально мутагенными и канцерогенными свойствами.
Наиболее распространенные представители:
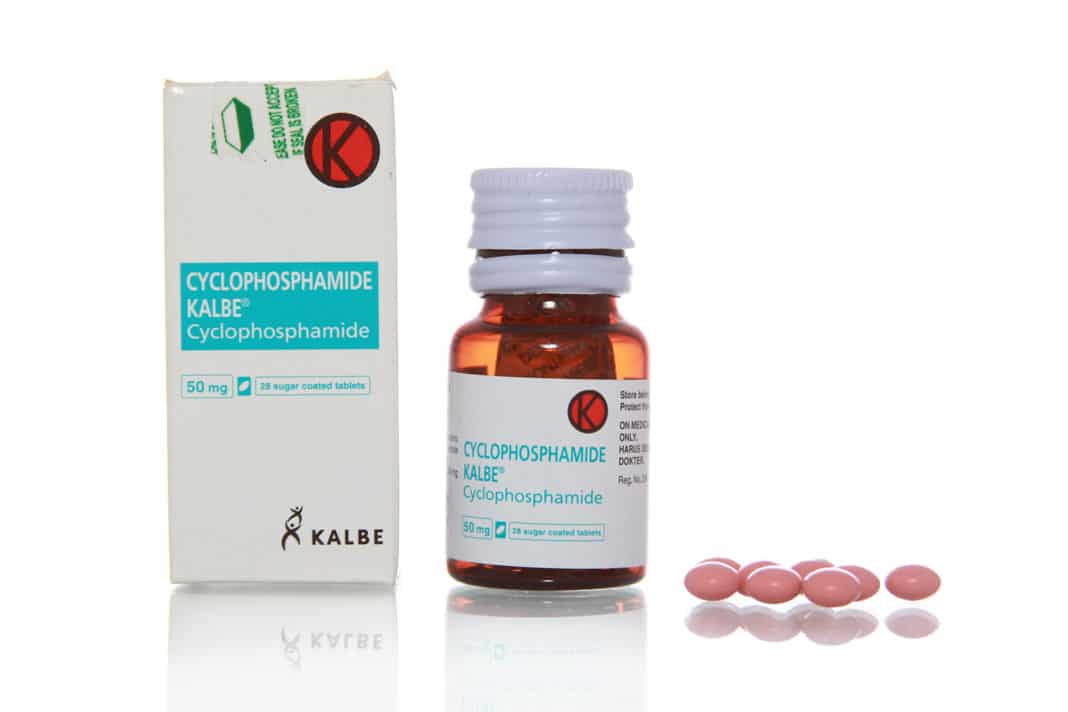
- циклофосфамид, ифосфамид, мафосфамид, трофосфамид;
- бендамустин, хлорамбуцил;
- эстрамустин.
Антиметаболиты
Антиметаболиты представляют собой химические соединения, которые по своей химической структуре напоминают природные метаболиты, но ингибируют их путь. Результатом является нарушение нормальной функции фермента в метаболическом пути или биологическом процессе. Антиметаболиты могут быть эффективными цитостатическими препаратами.
Многие антиметаболит являются химическими аналогами аминокислот или оснований ДНК. Примеры лекарственных препаратов этой группы:
- Аналоги пуриновых и пуриновых нуклеозидов: 6-меркаптопурин, 6-тиогуанин;
- Аналоги пиримидиновых и пиримидиновых нуклеозидов: фторурацил, цитарабин, гемцитабин, тегафур, капецитабин.
Антрациклины
Антрациклины действуют путем связывания с ферментом топоизомеразой IIα. Препараты внедряются в ДНК, предотвращая тем самым дальнейший синтез нуклеиновых кислот. Другой механизм действия заключается в том, что биотрансформация генерирует свободные радикалы, повреждающие клетки.
Антрациклины могут способствовать нарушению функции митохондрий. Связывание антрациклинов с клеточной мембраной повышает их проницаемость и текучесть, что приводит к увеличению гибели пораженной клетки.
Алкалоиды барвинка
Алкалоиды барвинка, которые также являются компонентами вечнозеленых растительных цитотоксических агентов, называются «веретенообразующими токсинами». Они действуют на микротрубочки и ингибируют процессы деления клеток. Представителями алкалоидов барвинка являются винбластин и винкристин.
Современные методы химиотерапии
При большинстве злокачественных заболеваний противоопухолевые препараты при раке сочетаются с другими процедурами – операция или облучение. Вспомогательная адъювантная химиотерапия назначается после операции или облучения. Цель вспомогательных процедур – бороться с любой остаточной опухолью и метастазами.
Химиотерапия также может быть выполнена до операции или лучевой терапии. Эта «неоадъювантная» химиотерапия в первую очередь направлена на уменьшение размера опухоли, тем самым обеспечивая лучшую отправную точку для дальнейшего лечения.
Особой формой лечения является так называемая «высокодозная химиотерапия» с трансплантацией стволовых клеток при лейкозах. Она разрушает больной костный мозг пациента с помощью особенно интенсивной химиотерапии. Затем пациент получает донорские стволовые клетки (аллогенные трансплантаты стволовых клеток) или собственные, очищенные от больных клеток.
Схема лечения химиотерапией зависит от различных факторов и должна определяться индивидуально для каждого пациента. Часто используется не только один препарат, а комбинация нескольких цитостатиков с различными принципами действия. Успех лечения должен сочетаться с минимальным количеством побочных эффектов.
Химиотерапия проводится с интервалами, называемыми циклами. Причем периоды лечения чередуются с перерывами. В одном цикле цитостатики вводят один или несколько дней подряд. За этим следует перерыв в лечении на несколько дней, недель или месяцев.
В перерыве лечения организм должен получить возможность восстанавливать пораженную нормальную ткань, которая обычно восстанавливается быстрее после химиотерапии, чем опухолевая. В среднем проводится от 4 до 6 циклов.
САR Тклеточная терапия
CAR-T-клеточная терапия является вариантом терапии для пациентов, страдающих диффузной B-клеточной лимфомой. При CAR-T-клеточной терапии специфический белок на поверхности опухоли распознается ранее измененными T-клетками, что приводит к разрушению опухоли.
Это открывает новый вариант лечения для больных пациентов в дополнение к предыдущей стандартной химиотерапии. Потому что время выживания после стандартной терапии через 2 года составляет всего 20%. При CAR-T-клеточной терапии общая выживаемость составляет 40%.
Диффузная крупная В-клеточная лимфома является наиболее распространенной лимфомой в России. Это очень агрессивное состояние, которое обычно лечат комбинацией химиотерапии и иммунотерапии. При этой схеме около 50% случаев можно вылечить навсегда. У другой половины пациентов возникает рецидив, который плохо поддается лечению.
При CAR-T-клеточной терапии Т-клетки удаляются путем диализа и генетически модифицируются в специальном оборудовании. На третьем этапе терапии измененные Т-клетки увеличиваются и повторно вводятся пациентам с помощью инфузии. Измененные Т-клетки теперь могут распознавать опухолевые клетки и разрушать их последовательно. Поскольку Т-клетки остаются в организме и продолжают размножаться, они могут распознавать и разрушать раковые клетки в долгосрочной перспективе с поверхностным признаком CD19.
Поскольку CAR-T-клеточная терапия вызывает сильный иммунный ответ, терапия проводится как часть стационарной госпитализации, при которой за пациентами можно хорошо наблюдать. Процедура очень сложна и может быть выполнена только междисциплинарным способом. Следующая цель исследователей – выяснить, почему 40% пациентов реагируют на терапию CAR-T-клетками и, следовательно, могут быть излечены, а остальные 60% – нет.
Молекулярнотаргетная терапия
Таргетная терапия использует определенные биологические и цитологические характеристики ткани раковой опухоли. Поскольку эти функции обычно встречаются редко на здоровых клетках, таргетная терапия рака должна быть более совместимой и эффективной.
Новые вещества сочетаются с общепринятыми терапевтическими методами: хирургия, химиотерапия и лучевая терапия.
Некоторые лекарственные средства или терапевтические подходы, такие как моноклональные антитела, попадают в область иммунотерапии рака, которая является формой таргетной терапии рака.
Перспективные направления и препараты в онкологии
Разработка новых противоопухолевых препаратов имеет высокий приоритет в научно-исследовательской фармацевтической промышленности. В 2018 году было выпущено 12 противораковых препаратов.
Также стали доступны первые 2 клеточные терапии CAR-T. Определенные иммунные клетки (Т-клетки) взяты у пациента и превращены в лекарственное средство в лаборатории путем генетической модификации.
После возвращения в организм они могут обнаружить и уничтожить раковые клетки. Пока что это лечение доступно только для нескольких пациентов с определенными лейкемиями или лимфомами.
Другие препараты для лечения рака в настоящее время находятся в процессе одобрения или уже получили одобрение, но еще не продаются в России. Для многих пациентов показатели выживаемости увеличиваются на недели, месяцы или годы, в зависимости от типа рака. Некоторые ранние смертельные формы рака стали хроническими заболеваниями сегодня.
Каковы недостатки химиотерапии?
Химиотерапия, повреждающая клетки, воздействует не только на раковые клетки, но и на все другие клетки, которые естественным образом быстро делятся. Результатом являются нарушения в пищеварительном тракте – воспаление слизистой оболочки полости рта, тошнота, рвота, потеря аппетита, диарея и боль в животе, изменения уровня крови при анемии, нарушения свертываемости крови и повышенный риск инфицирования.
Побочные эффекты могут проявиться через несколько часов или дней после начала лечения, но также через несколько месяцев или даже лет. Многие побочные эффекты сегодня могут быть предотвращены или, по крайней мере, смягчены соответствующими мерами (поддерживающая терапия). В настоящее время существуют лекарства, которые предотвращают тошноту и рвоту или поддерживают регенерацию клеток крови.

Также разрабатываются и проходят клинические испытания новые цитостатики, которые, как говорят, являются особенно селективными: они в первую очередь воздействуют на опухолевые клетки и оставляют здоровые клетки в значительной степени неповрежденными.
Примером является инкапсулированные цитостатики: капсулы могут быть «открыты» только ферментами, типичными для опухолевых клеток. Поэтому цитотоксин будет высвобождаться только в «больных» клетках. Улучшения также ожидаются от так называемых «исследований оптимизации терапии». Они определяют, какие цитотоксические препараты должны сочетаться друг с другом и каким образом, чтобы они были эффективными и имели мало побочных эффектов. Перед применением любых лекарственных препаратов рекомендуется проконсультироваться с врачом.
Частые вопросы
Какие виды препаратов используются для лечения рака?
Для лечения рака используются различные виды препаратов, включая химиотерапию, иммунотерапию, таргетированную терапию, гормональную терапию и препараты для лучевой терапии.
Какие препараты считаются наиболее эффективными и безопасными для лечения рака?
Наиболее эффективные и безопасные препараты для лечения рака зависят от типа рака и индивидуальных особенностей пациента. Некоторые из них включают таргетированные препараты, иммунотерапию и инновационные методы лечения, такие как CAR-T-клеточная терапия.
Полезные советы
СОВЕТ №1
Обратитесь к онкологу для получения рекомендаций по выбору препаратов от рака. Каждый вид рака требует индивидуального подхода, и только специалист сможет подобрать наиболее эффективное и безопасное лечение.
СОВЕТ №2
Изучите информацию о препаратах, прошедших клинические испытания и получивших одобрение от медицинских организаций, таких как FDA (Администрация по контролю за продуктами и лекарствами США) или EMA (Европейское агентство по лекарственным средствам). Это поможет вам оценить эффективность и безопасность препаратов.
СОВЕТ №3
Исследуйте возможности клинических испытаний и инновационных методов лечения рака, таких как иммунотерапия и молекулярно-целенаправленная терапия. Некоторые новые препараты могут быть более эффективными и безопасными, чем традиционные методы лечения.